PRESENTACIÓN
La Comisión de Viabilidad del Hospital Universitario de Getafe es un órgano asesor de la Gerencia de este Hospital (en adelante HUG), constituido para evaluar la posibilidad de llevar a cabo todos los estudios clínicos, proyectos, TFG, y tesis doctorales, en función de los medios materiales y humanos requeridos en la memoria científica (protocolo) y económica del proyecto a efectos de ser autorizada su ejecución por el HUG como por la Fundación para la Investigación del Hospital Universitario de Getafe (en adelante FIBHUG).
La Comisión de Viabilidad del HUG tiene como finalidad:
a) Verificar la viabilidad de todos los estudios de investigación clínica que se desarrollen en el hospital, con exclusión de las consideraciones éticas que tienen otro ámbito de competencia.
b) Realizar y mantener actualizada una base de datos de todos los estudios que se realicen en el hospital.
c) Valorar la viabilidad o no de la realización del estudio en el HUG.
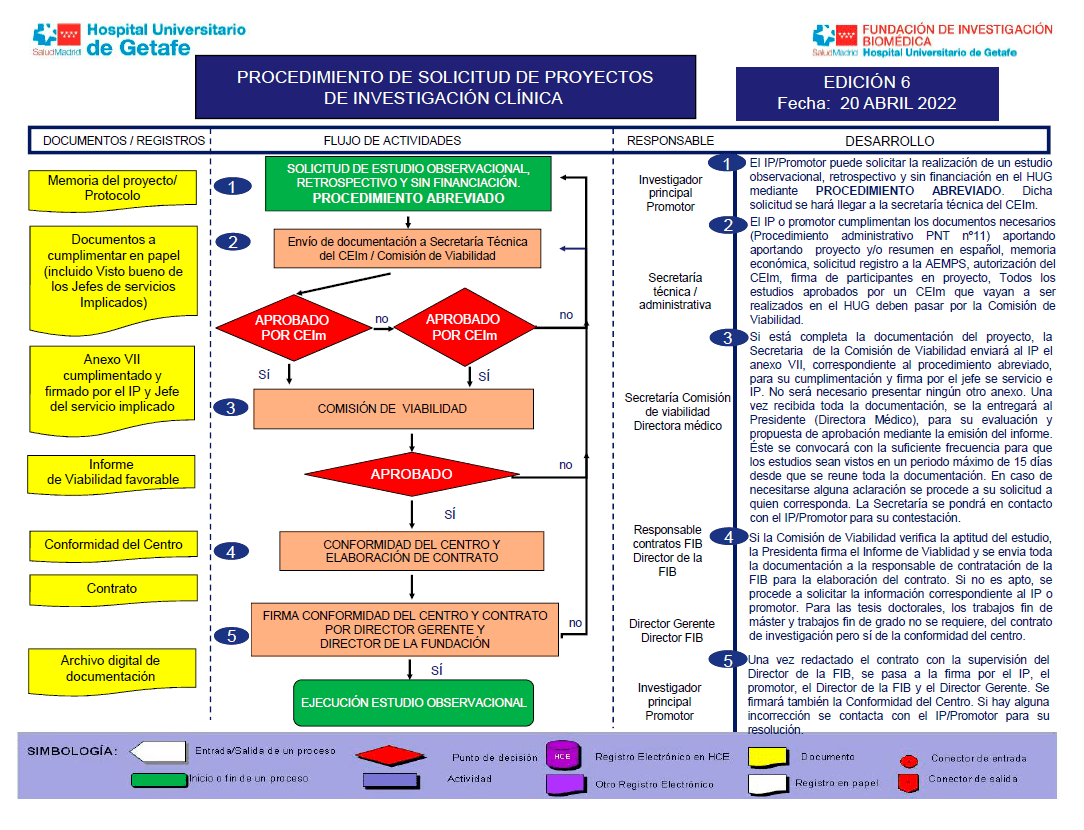
Todos los estudios clínicos (ensayos clínicos con medicamentos o productos sanitarios, estudios observacionales, proyectos de investigación, trabajos fin de grado o tesis doctorales) que se vayan a realizar en nuestro centro serán evaluados por dicha Comisión y han de contar con el Dictamen favorable de un CEIm.
COMPOSICIÓN
La Comisión de Viabilidad está formada por miembros del CEIm, de la Dirección del centro y de la FIBHUG, estructuras necesarias para la puesta en marcha de estudios de investigación.
La composición de esta Comisión será como sigue:
- Directora Médico
- Director de Gestión
- Directora de Enfermería
- Presidente CEIm
- Directora de la FIBHUG
- Responsable de contratación de la FIBHUG
- Farmacéutico del Hospital
- Jefa de Servicio de Informática
- Secretaria técnica del CEIm
REUNIONES.
La Comisión de Viabilidad se reunirá en convocatoria ordinaria, con la periodicidad necesaria en función de las solicitudes recibidas, tras la convocatoria por parte de la Presidenta de dicha Comisión.
En situaciones excepcionales y siempre que esté justificado, la Presidenta podrá adelantar o retrasar la convocatoria de la reunión.
En cada reunión se revisarán todos los estudios clínicos que se vayan a realizar en nuestro centro y que cuenten con la aprobación de un CEIm de ámbito nacional.
REQUISITOS Y DOCUMENTACIÓN A PRESENTAR
Los estudios clínicos que hayan sido evaluados por el CEIm del HUG y que cuenten con el Dictamen favorable, la Secretaria Técnica del CEIm, remitirá la documentación de la investigación a la Comisión de Viabilidad.
La secretaria de la Comisión de Viabilidad se pondrá en contacto con el investigador principal del estudio o promotor para solicitarle la documentación (Anexos) necesaria para la emisión de la Conformidad del Centro.
Los estudios clínicos aprobados por un CEIm del territorio nacional que vayan a realizarse en nuestro centro, el promotor o investigador principal se pondrá en contacto con la secretaria de la Comisión de Viabilidad o a la Secretaría de la Fundación, quién le informará de la documentación a presentar para su evaluación.
La documentación la enviaremos tal y como se describe en la web, a la dirección de la Secretaría de la Comisión de Viabilidad (coordinaciondeestudiosclinicos@iisgetafe.com) y Responsable de Contratación de la Fundación (contratosinvestigacion@iisgetafe.com)
Requisitos para ser evaluado por la Comisión de Viabilidad
Relación de documentos a presentar por el promotor/CRO/ Investigador Principal:
Documentación del expediente
- Protocolo.
- Resumen del protocolo, si hay como tal (en castellano).
- Hoja de Información al Participante.
- Consentimiento Informado.
- Dictamen del CEIC/CEI/CEIm.
- Aprobación AEMPS, en caso de ensayo clínico o EPA-SP.
- Póliza de seguro (si procede, obligatorio en ensayos clínicos).
- Idoneidad de las Instalaciones/ Idoneidad del Investigador.
- CV del Investigador Principal.
- Compromiso del Investigador Principal/ Compromiso del Equipo Investigador.
- Detalle (Nombre y Apellidos) de la composición del Equipo Colaborador (si existe como tal).
- Memoria Económica (presentada al CEIm) / Memoria económica cero, si procede (requisitos)
- Fundación (FIB-HUG) como promotor (requisitos)
- Anexos (ver abajo)
Solicitud de memoria económica cero (requisitos), conforme a lo estipulado en reunión del Patronato, de fecha 20 de diciembre de 2017.
En caso de no tratarse de una memoria económica cero, se aplicará el overhead de la Fundación que corresponda, y los gastos de gestión del contrato que resulten aplicables según el estudio que se trate (ver apartado Modelos de contratos y gastos de gestión).
Requisitos e impreso de la Fundación como promotor conforme a lo estipulado en reunión del Patronato, de fecha 7 de agosto de 2018.
En el caso que se solicite por parte del Investigador Principal que la Fundación de Investigación Biomédica actúe como promotor en un estudio clínico, se deberá solicitar mediante el impreso y ser autorizado por la Comisión de Viabilidad.
En caso que la resolución sea favorable, deberá presentarse al CEIm como parte de su procedimiento.
Relación de anexos a cumplimentar y presentar (Anexos I a VII)
Anexo I.- Relación de procedimientos que está previsto realizar al paciente debido a su participación en el ensayo clínico/estudio. Anexo II.- Hoja de validación de la Comisión de Viabilidad Anexo III.- Conformidad personal dependiente de dirección de enfermería Anexo IV.- Conformidad del Servicio necesidad de dotación Anexo V.- Solicitud y conformidad del Servicio de Farmacia Anexo VI.- Conformidad del responsable del Servicio Anexo VII.- Procedimiento abreviado para estudios observacionales, retrospectivos sin financiación